|
1. はじめに
特許権の存続期間は、原則的に特許権が設定登録された日から特許出願日後20年となる日までである。しかし、出願後に設定登録されるまで長期間を要したり、特許発明の実施のために他の法令による許可などが必要な場合、存続期間が実質的に短縮されるという問題がある。このような問題を解決するために各国では特許権存続期間延長登録制度を設けており、以下、主要国(IP5)の存続期間延長登録制度について考察する。
2. 韓国
2.1. 登録遅延による特許権の存続期間の延長
特許出願日から4年または出願審査請求日から3年のうち遅い日よりも遅延して特許権の設定登録が行われた場合、その遅延された期間分、当該特許権の存続期間を延長することができる。ただし、出願人により遅延された期間は延長可能期間から除外される。出願人により遅延された期間としては、出願人が審判請求期間または特許に関する手続の指定期間を延長した場合、出願人の事由により審査、審判など特許に関する手続が中断または中止された場合などがある。
2.2. 許可などによる特許権の存続期間の延長
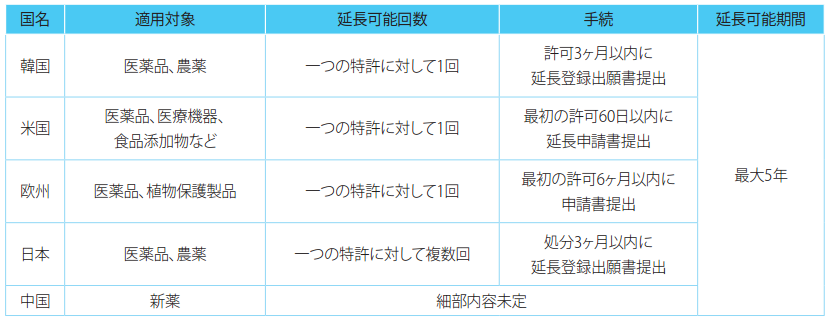
医薬品および農薬に関する特許発明を実施するために関連機関の許可などを必要とし、許可などを受けるために有効性および安定性試験など関連手続の遂行により相当期間を要する場合、特許発明を実施することができなかった期間に対して5年の範囲内で特許権の存続期間を延長することができる。この時、許可を受ける必要性が認められなければならず、特許権者などが許可を受けなければならない。また、特許発明を実施することができなかった期間とは、許可を受けるための試験期間と許可申請関連書類の検討期間を合算した期間である(韓国特許庁告示第2015-19号)。許可などによる特許権の存続期間延長のためには、当該特許権者が許可などを受けた日から3ヶ月以内に延長対象特許権の特許番号および延長対象の請求の範囲、延長申請期間、許可などの内容を記載した延長登録出願書を提出しなければならず、一つの特許に対しては1回に限り存続期間延長が可能である。ただし、存続期間満了前6ヶ月以降には延長登録出願を行うことができない。
3. 米国
3.1. 特許存続期間の調整(Patent Term Adjustment;PTA)
審査遅延の理由により、米国特許庁(以下、USPTOという。)が特許出願日から3年以内に特許登録しなかった場合、3年が経過した日から特許登録日までの期間分の特許期間が延長される。ただし、出願人の要請により遅延された期間などは延長されない。韓国とは異なり、米国のPTA制度は、USPTOが調整期間を決定してこれを許与通知書に表示して出願人に通知し、出願人は調整期間に対して異議がある場合には異議を提起することができる。
3.2. 特許存続期間の延長(Patent Term Extension;PTE)
米国の特許権存続期間の延長(PTE)は、特許製品に対して商業的市販や使用に先立ち、規制検討期間(Regulatory Review Period;RRP)を経なければならない対象となる場合、その製品(製品の使用方法および製品の製造方法)に対する特許の存続期間を一定期間延長することができる制度である。この時、製品とは、医薬品、医療機器、食品添加物などを意味し、医薬品は新薬の有効成分であって、その有効成分の塩またはエステルを含むが、医薬品の組成物全体を意味するものではない。延長期間はRRPに基づいて決定し、当局(FDAなど)においてRRPを算定した上で、USPTOにより最大5年の範囲で延長期間が算定される。具体的に延長期間は次のように算定される。
* 延長期間=(X-D1)×1/2+(Y-D2)
X=臨床試験期間
D1=臨床試験期間中の権利者の帰責により遅延された期間
Y=規制検討期間
D2=規制検討期間中の権利者の帰責により遅延された期間
PTE申請は、当局の承認を受けた日から60日以内に提出しなければならない。
4. 欧州
4.1. 補充的保護証明書制度
欧州特許条約(European Patent Convention;EPC)は、医薬品関連特許権の存続期間満了後、追加的な権利を付与する補充的保護証明書(Supplementary Protection Certificate;SPC)制度を運用している。SPCは、当該特許権自体の存続期間を延長するのではなく、特許権の存続期間満了後、医薬品許可などの理由により実施することができなかった期間に対して別途のSPCを付与して独占販売権利を付与する形態の制度である。
4.2. SPC適用対象および申請手続
SPCの適用対象は、ヒトおよび動物用医薬品の有効成分、植物保護製品の活性物質であると規定しており、SPC申請の基礎となる特許は、製品、製品の製造方法、製品の用途に関する特許である。SPC申請日を基準として有効な基本特許により保護されている製品でなければならず、SPCの基礎となる許可は医薬品または植物保護製品の上市のための許可であって、最初の許可でなければならない。SPC申請のためには上市のための許可日から6ヶ月(許可日が特許付与日よりも早い場合、特許付与日から6ヶ月)以内にSPC申請書を提出しなければならない。SPCによる保護期間は「基本特許の出願日」から「欧州内の最初の市販承認が許与された日」までの期間から5年を差し引いた期間であり、最大5年まで認められる。
5. 日本
5.1. 登録遅延による存続期間延長
日本は韓国と類似して、出願日から5年または審査請求日から3年のうちいずれか遅い日以後に特許権設定登録が行われた場合、当該期間に対して延長登録出願を経て特許権存続期間を延長することができる。実質的に韓国と同一の制度である。
5.2. 許可などによる存続期間延長
特許発明の実施に対して安全性確保などを目的として法律の規定による許可、その他の処分であって、処分に相当な期間を要する場合、5年を限度に存続期間を延長することができる。許可、その他の処分としては、農薬、医薬品類と関連した承認、認証を意味する。また、政令で定められた処分を受けた日から3ヶ月以内に特許権者が延長登録出願をしなければならない。延長可能期間は最大5年以内で、特許権設定登録日から試験に必要な期間と処分申請後に処分を受けた時までの期間を合算した期間である。
6. 中国
2021年6月1日施行の改正法により、中国でも登録遅延または許可などによる遅延に対して存続期間延長制度を設けている。
6.1. 登録遅延による存続期間延長
韓国と類似して、特許出願日から4年、実質審査請求日から3年が経過した場合、特許期間に対する補償申請が登録日から3ヶ月以内に可能である。ただし、出願人により発生した遅延は除外される。
6.2. 許可などによる存続期間延長
新薬販売審査評価許可による期間を補償するために、中国で販売許可を受けた新薬関連発明に対して特許権者の請求により存続期間を延長することができる。ただし、最大5年以内の期間であって、新薬販売許可後の特許権の全体有効期間は14年を超えてはならない。
[表] 主要国の許可などによる特許権の存続期間延長制度の要約
*参考資料:2017年「特許権の存続期間延長登録出願制度の運用に関する外国の法制、判例および問題点に関する研究」政策研究報告書、「米国特許法」イ・ヘヨン著
|